4.7. Interactions avec d'autres polluants
L'ozone est un polluant secondaire, c'est-à-dire, qu'à
de rares exceptions près, il n'est pas émis directement
par l'activité humaine, mais est formé par des processus
chimiques complexes à partir d'autres polluants, appelés
précurseurs. Cette caractéristique rend la lutte
contre la pollution par l'ozone difficile et diminuer la pollution
pour un polluant précurseur peut mener à des effets
négatifs et augmenter ainsi les taux d'ozone.
Les différentes réactions entre l'ozone et les oxydes
d'azote peuvent se résumer par l'équilibre suivant :
NO2 + O2 + U.V. --> O3 + NO
L'ozone est donc formé par réaction entre le dioxyde
d'azote et l'oxygène atmosphérique en présence
de radiation solaire. La réaction inverse est possible :
l'ozone est détruit par le monoxyde d'azote pour donner
du dioxyde d'azote. Si la formation d'ozone est un phénomène
lent (plusieurs heures), la destruction par le NO est rapide (quelques
minutes).
Il existe un équilibre entre ces réactions de formation-destruction
et, dans les conditions normales, le taux d'ozone reste stationnaire.
Cet équilibre peut être brisé par la présence
de composés organiques volatils avec, pour conséquence,
une augmentation de la teneur en ozone.
Les variations nycthémérales (c'est-à-dire
les variations de concentrations selon un rythme de 24 heures)
de l'ozone résultent de cet équilibre. La journée,
sous l'influence des rayons solaires, l'ozone est formé
à partir du dioxyde d'azote (la destruction continue mais
l'effet global observé est une augmentation de l'ozone).
Pendant la nuit, seule la réaction de destruction subsiste
et l'ozone diminue en formant une " réserve "
de dioxyde d'azote qui pourra reformer de l'ozone le jour suivant.
En été, on observe une augmentation de la concentration
d'ozone entre 10 et 21 h, puis une diminution, due au processus
de destruction. Les variations d'ozone dépendent de sa
destruction plus ou moins forte et, selon le type d'environnement,
il existe des différences notables entre ces variations
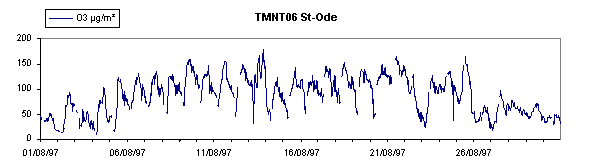
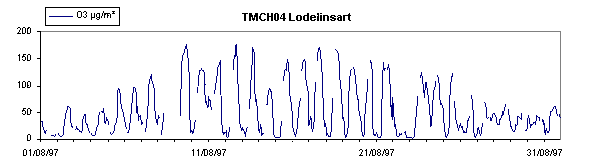
nycthémérales (Figure 52).
Dans un environnement urbain, la production d'ozone est forte
pendant la journée et sa destruction est rapide pendant
la nuit. Les pics sont bien marqués, alors qu'en milieu
rural et en l'absence de NO, la destruction est plus faible et
les variations sont moindres, bien que le niveau général
soit plus élevé (ligne de base plus haute).

Les différences entre les types de milieux s'observent
également sur la représentation d'une journée
moyenne en ozone (Figure 53).
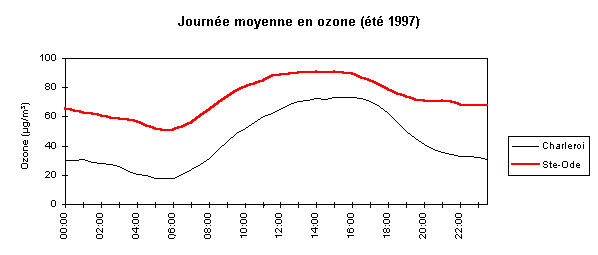
Dans les agglomérations, les variations de teneurs en ozone
sont plus importantes et les valeurs maximales se produisent plus
tard dans la journée (14-17 h), contrairement aux stations
rurales (12-16 h), la destruction d'ozone retardant l'apparition
du maximum. De même, les minima nocturnes sont plus élevés
en milieu rural.
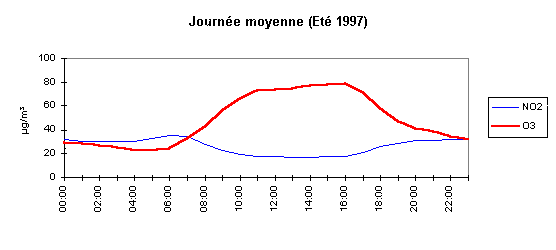
Sur le graphique de la Figure 54, on observe bien la diminution
de la teneur en dioxyde d'azote conséquente de la réaction
de formation d'ozone pendant la journée.
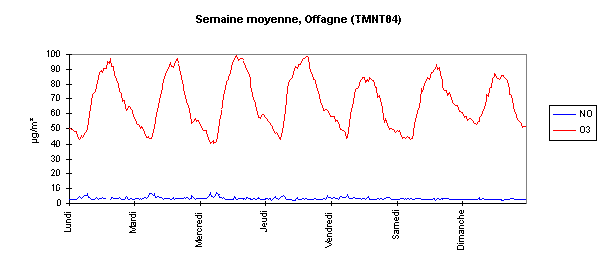
Sur la Figure 55, sont repris les graphiques des semaines moyennes
pour les stations de Charleroi (urbain) et d'Offagne (rural).
Ces profils sont intéressants à plus d'un titre.
Tout d'abord, on remarque qu'à Charleroi, les concentrations
en monoxyde d'azote sont plus fortes et, par conséquent,
les concentrations en ozone plus faibles que pour la station rurale.
Les maxima en ozone sont plus élevés les week-ends.
Le samedi, il y a formation abondante d'ozone en raison de l'influence
des émissions de circulation relativement élevées
de la veille, la destruction étant inférieure à
cause de la réduction de l'intensité de la circulation.
Le dimanche, la formation d'ozone est inférieure vu la
circulation moins abondante du samedi, tandis que sa destruction
est inférieure ou du même ordre que le samedi. Le
maximum du dimanche est alors plus faible que celui du samedi.
Pour les mêmes raisons, les maxima du week-end ont lieu
plus tôt dans la journée.
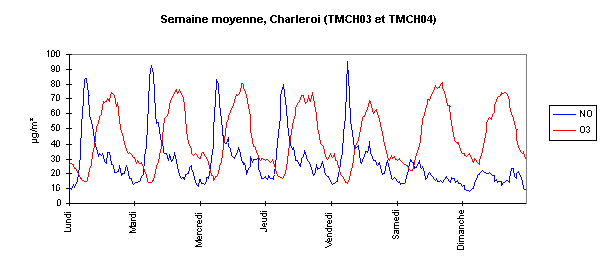
Aux premières heures de la matinée, l'ozone est
en diminution. Ce creux est bien plus marqué pour un milieu
urbain et pour les jours ouvrables en raison du pic important
de la concentration en monoxyde d'azote (pic de l'heure de pointe).
L'analyse de la différence entre les concentrations mesurées
les jours ouvrables et les week-ends montre qu'une limitation
des émissions d'oxydes d'azote (comme par exemple une interdiction
de la circulation) peut, à très court terme, entraîner
une augmentation de la concentration en ozone.
Haut de page
Ozone: menu
Menu général
4.7.2. Les composés organiques volatils
(COVs)
Les composés organiques volatils jouent un rôle important
dans le schéma de réaction de l'ozone. Dans la couche
de mélange, l'ozone est formé par réaction
entre une molécule d'oxygène et un atome d'oxygène
provenant de la photolyse du dioxyde d'azote (la dissociation
d'une molécule d'oxygène requiert des rayons UV
plus énergétiques et n'a lieu que dans la stratosphère)
:
NO2 + U.V. --> O + NO (210 nm < longueur d´onde < 320 nm)
O + O2 --> O3
L'oxygène atomique peut aussi réagir avec une molécule
d'eau pour donner des radicaux hydroxyles (OH) :
O + H2O --> 2 OH
A leur tour, ces radicaux peuvent attaquer un composé organique
volatil (RH); le monoxyde d'azote est transformé en dioxyde
d'azote et le radical hydroxyle (OH) est régénéré;
le processus peut alors recommencer :
RH + OH + O2 --> RO2 + H2O
NO + RO2 --> NO2 + RO
RO + O2 --> carbonyl + HO2
HO2 + NO --> OH + NO2
Le dioxyde d'azote peut alors subir une nouvelle photolyse menant
à la production d'ozone.
Ce schéma de réaction perturbe l'équilibre
entre la production et la destruction d'ozone, en consommant du
monoxyde d'azote (diminution de la destruction) et en produisant
du dioxyde d'azote (augmentation de la production d'ozone). La
photolyse d'une seule molécule de NO2, en donnant
deux radicaux hydroxyles, entraîne la production de 2 molécules
de NO2 pouvant donner naissance à 2 molécules
d'ozone.
Une même chaîne carbonée pourra subir plusieurs
décompositions suivant sa structure. Tous les composés
carbonés n'ont pas la même réactivité
vis-à-vis des radicaux hydroxyles et tous n'auront donc
pas le même effet sur les concentrations en ozone. En règle
générale, on considère que les composés
insaturés (alcènes, aromatiques, ...) ont une réactivité
supérieure et un impact plus grand sur l'ozone.
Le toluène a une plus grande réactivité que
le benzène et certaines études ont montré
que le rapport entre ces deux polluants pouvait évoluer
avec le taux d'ozone, alors que leurs émissions restaient
dans un rapport identique.
L'analyse des interactions entre la production d'ozone et les
composés organiques volatils pour la Région wallonne
semble encore prématurée car nous ne disposons actuellement
que de mesures d'hydrocarbures totaux. La mise en place du réseau
COVs devrait apporter des renseignements intéressants quant
à la chimie de ces composés. Toutefois, on peut
déjà remarquer que pour une station urbaine, on
observe un pic matinal correspondant à l'heure de pointe,
signe qu'une fraction importante des COVs provient du trafic (voir
chapitre 7).
Haut de page
Ozone: menu
Menu général
La formation des oxydants photochimiques ne peut être influencée
que par un changement de l'émission des précurseurs.
Mais si la diminution des COVs apparaît presque toujours
comme positive, la diminution des oxydes d'azote peut entraîner
à court terme une augmentation des taux d'ozone (ce qui
apparaît lors des week-ends). En cas d'épisodes de
pollution, une interdiction de la circulation motorisée
apparaît à court terme comme préjudiciable
d'un double point de vue, les activités en plein air risquant
d'augmenter (vélo, ...) exposant ainsi un plus grand nombre
de personnes. De plus, la diminution des précurseurs n'entraîne
pas une diminution proportionnelle de l'ozone et le comportement
de ce polluant peut varier selon les régions.
Il est également nécessaire de bien connaître
les sources de précurseurs. Si le trafic apparaît
comme une source importante (surtout en été) pour
les oxydes d'azote et les COVs, les émissions d'origine
naturelle ne doivent pas être négligées.
Ces considérations impliquent qu'il est difficile d'élaborer
une stratégie de lutte efficace. Il est cependant certain
que si des mesures sont nécessaires, les décisions
doivent être concertées à un niveau international.
Haut de page
Ozone: menu
Menu général